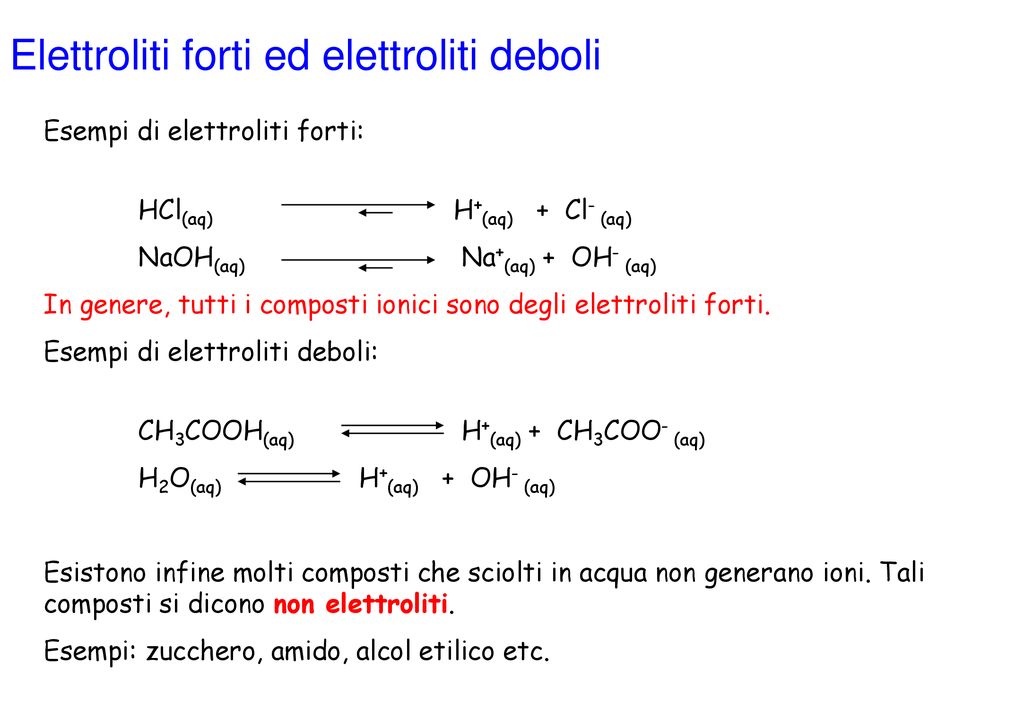
ENTITA' DI DISSOCIAZIONE: ELETTROLITI FORTI E DEBOLI A parità di concentrazione molare, gli elettroliti sono dissociati o ionizzano in quantità diversa. La frazione di elettrolita dissociata è determinata dal grado di dissociazione e si indica con α. Fattori che influenzano dipenda da:-Natura del soluto - Natura del solvente - temperatura. Gli elettroliti forti hanno conducibiltà molari che aumentano poco al crescere della diluizione. Gli elettroliti deboli hanno conducibilità molari molto più basse a concentrazioni alte. Le Λ aumentano notevolmente al crescere della diluizione. Tale metodo non è soddisfacente per elettroliti deboli,

PPT Elettroliti PowerPoint Presentation, free download ID5967524

Calcolo del pH con elettroliti forti e deboli YouTube
![PPT pH = log [H + ] = log 1/[H + ] da cui [H + ] = 10 pH PowerPoint Presentation ID3711708 PPT pH = log [H + ] = log 1/[H + ] da cui [H + ] = 10 pH PowerPoint Presentation ID3711708](https://image2.slideserve.com/3711708/acidi-e-basi-deboli-calcolo-ph-l.jpg)
PPT pH = log [H + ] = log 1/[H + ] da cui [H + ] = 10 pH PowerPoint Presentation ID3711708

Paradiso delle mappe Acidi e basi forti e deboli

Elettroliti forti e deboli quali sono, differenze, esempi 2024
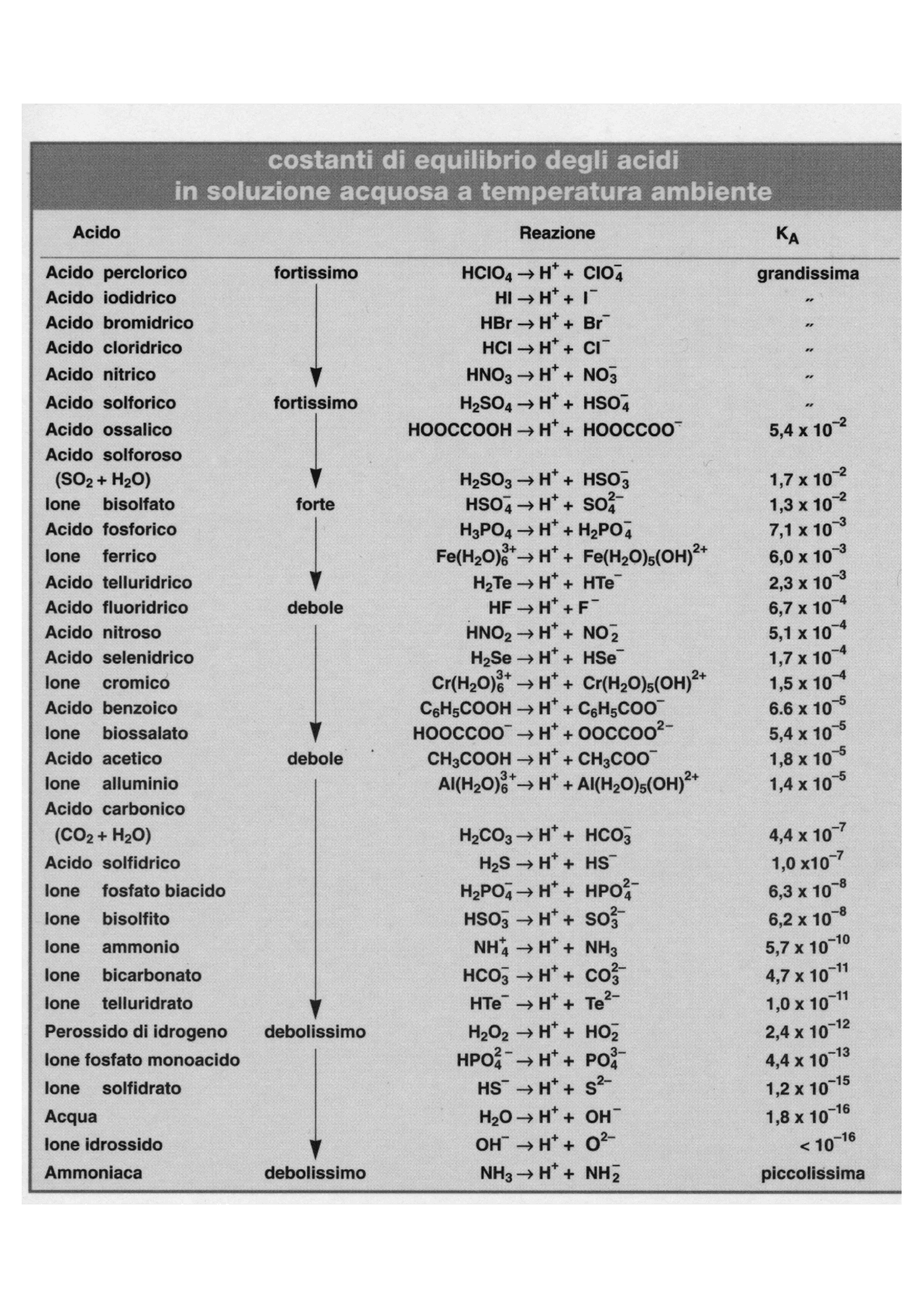
Tabella acidi deboli Docsity

Elettroliti YouTube

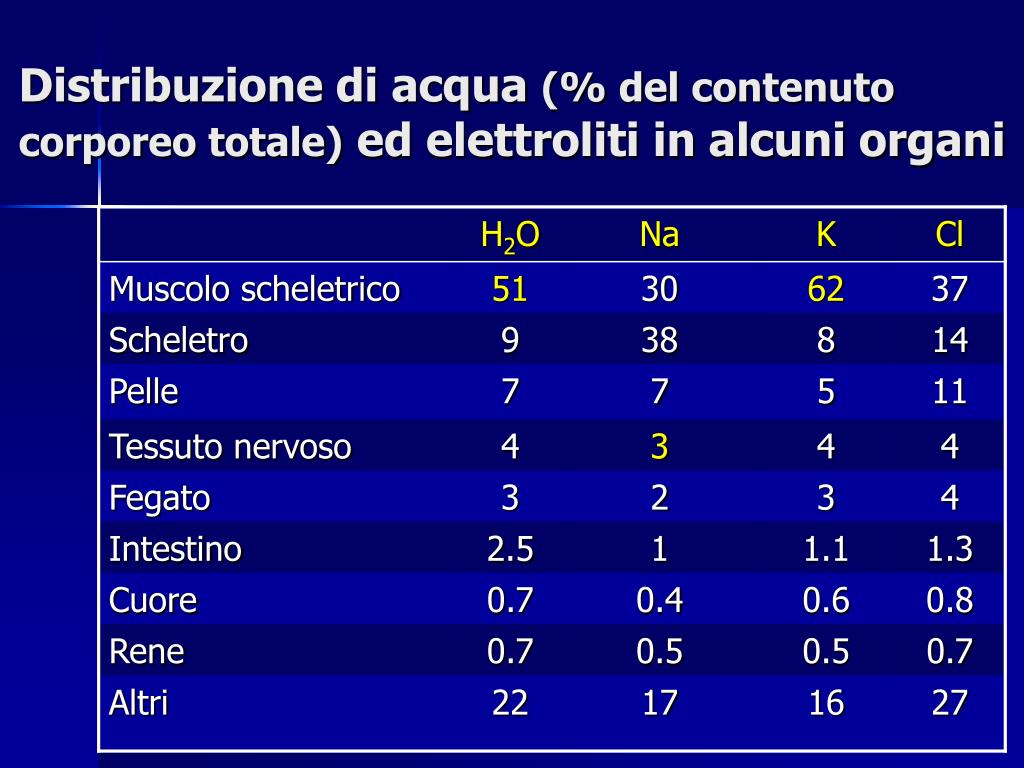
Elettroliti sostanze (acidi, basi e gran parte dei salicorsiadistanza.polito.it/corsi/pdf

Tabella Acidi Forti E Deboli sanuwest

deladelmur Acidi grassi

PPT L’equilibrio dell’acqua PowerPoint Presentation, free download ID3532790
PPT Elettroliti PowerPoint Presentation, free download ID1133930
Le soluzioni Sistema omogeneo costituito da almeno due componenti ppt scaricare

Dissociazione elettrolitica
Tabella Acidi Forti E Deboli sanuwest
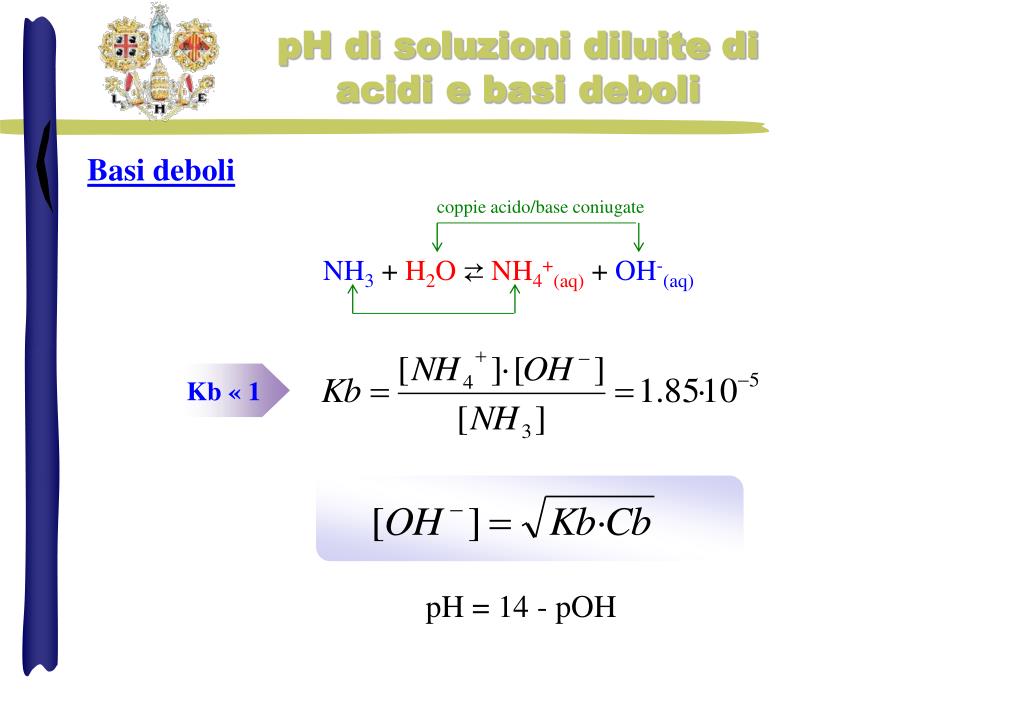
PPT pH di soluzioni diluite di acidi e basi forti PowerPoint Presentation ID4858981

PPT Chimica e laboratorio PowerPoint Presentation, free download ID4690463

ACIDI E BASI FORTI E DEBOLI YouTube

PPT Equilibri acidobase (seconda parte) PowerPoint Presentation, free download ID6260939
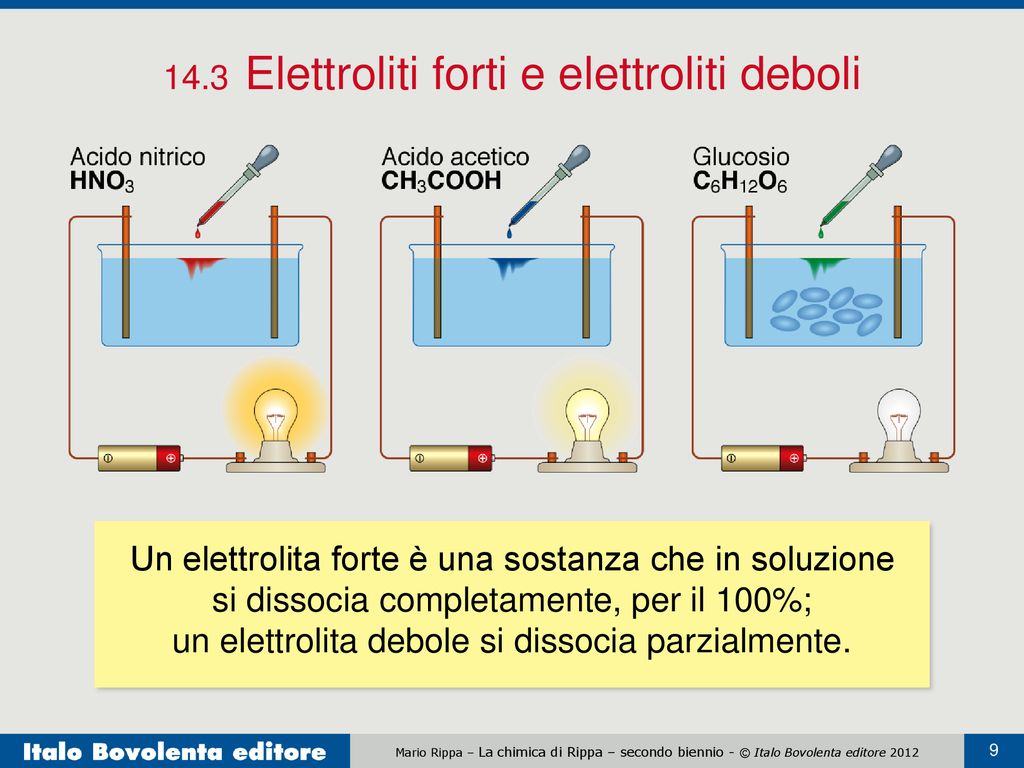
Quando un elettrolita si dice forte? Qual è lo
Soltanto nel caso che gli elettroliti siano entrambi forti, tenendo conto che si uniscono volumi uguali di acido e base alla stessa concentrazione, contenenti cioè un ugual numero di ioni H+ e OH-, il pH è 7; la reazione che avviene, infatti, è. H+ + OH- → H2O.. Una sostanza che, solubilizzata in acqua dà una soluzione che non conduce corrente elettrica è un non elettrolita: esempi di non elettroliti sono il saccarosio e il fruttosio. Elettroliti deboli. Oltre agli elettroliti forti vi sono gli elettroliti deboli: ad esempio una soluzione 0.10 M di HgCl 2 conduce una piccolissima quantità di corrente.